【安信医药】新药周观点:Dupilumab慢阻肺3期临床达到主要终点,相关领域有望迎来首个生物制剂

核心观点
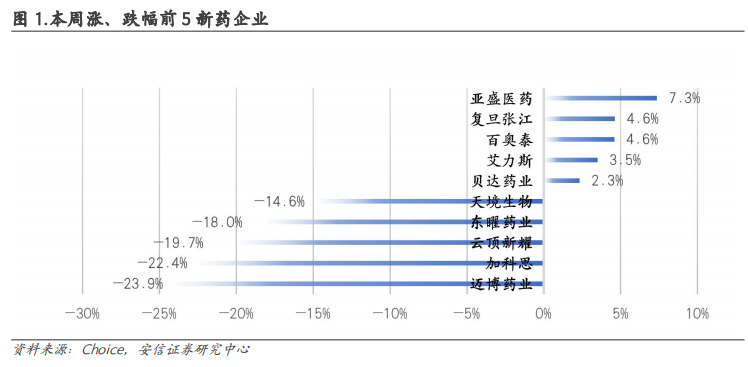
■本周新药行情回顾:2023年3月20日-2023年3月24日,新药板块涨幅前5企业:亚盛医药(7.3%)、复旦张江(4.6%)、百奥泰(4.6%)、艾力斯(3.5%)、贝达药业(2.3%)。跌幅前5企业:迈博药业(-23.9%)、加科思(-22.4%)、云顶新耀(-19.7%)、东曜药业(-18.0%)、天境生物(-14.6%)。
(1)3月23日,再生元/赛诺菲宣布Dupixent用于治疗慢性阻塞性肺病的关键3期BOREAS研究成功。数据显示,BOREAS研究达到了主要终点,即52周内中重度COPD的急性发作减少了30% 。
(2)3月20日,第一三共公布了patritumab deruxtecan的两项临床试验(U31402-A-U102和U31402-A-J101)结果,在HER2(0)患者中,patritumab deruxtecan的疗效更为优异。
(3)3月22日,安斯泰来公布zolbetuximab的3期临床研究GLOW的积极成果。相比于安慰剂联合CAPOX组,zolbetuximab与CAPOX联合用药将疾病进展或死亡风险降低了31.3%,达到主要终点。
风险提示
欢迎联系安信医药马帅团队,详询:
马帅:18321356864
mashuai@essence.com.cn
连国强:15721536645
liangq@essence.com.cn

目录


正文部分
1. 本周新药行情回顾
2023年3月20日-2023年3月24日,新药板块
涨幅前5企业:亚盛医药(7.3%)、复旦张江(4.6%)、百奥泰(4.6%)、艾力斯(3.5%)、贝达药业(2.3%)。
跌幅前5企业:迈博药业(-23.9%)、加科思(-22.4%)、云顶新耀(-19.7%)、东曜药业(-18.0%)、天境生物(-14.6%)。
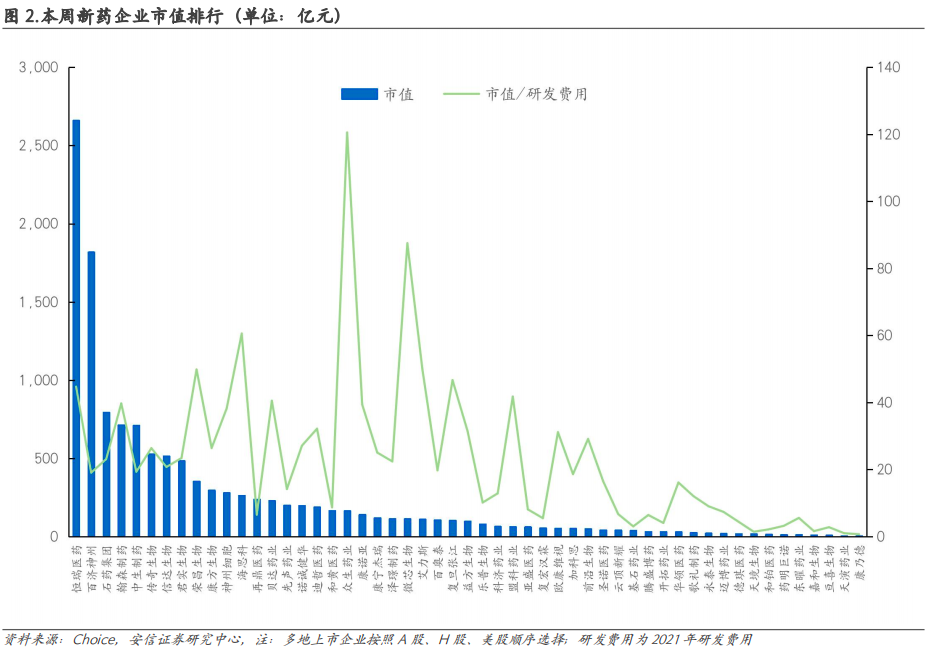
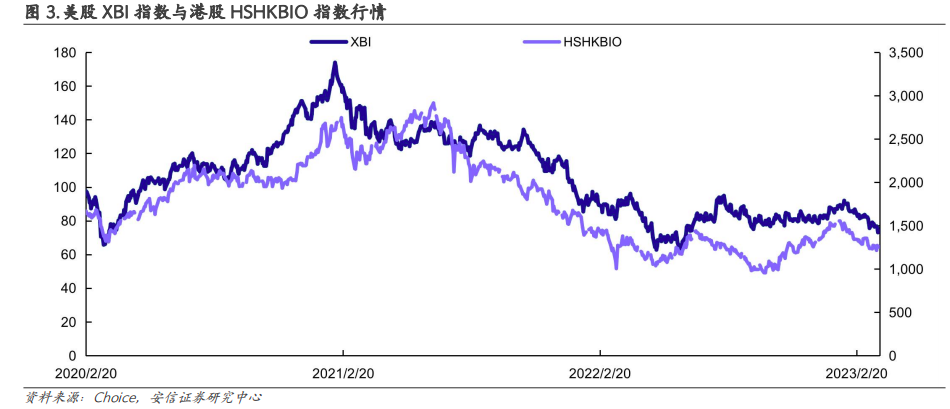
2. 本周新药行业重点分析
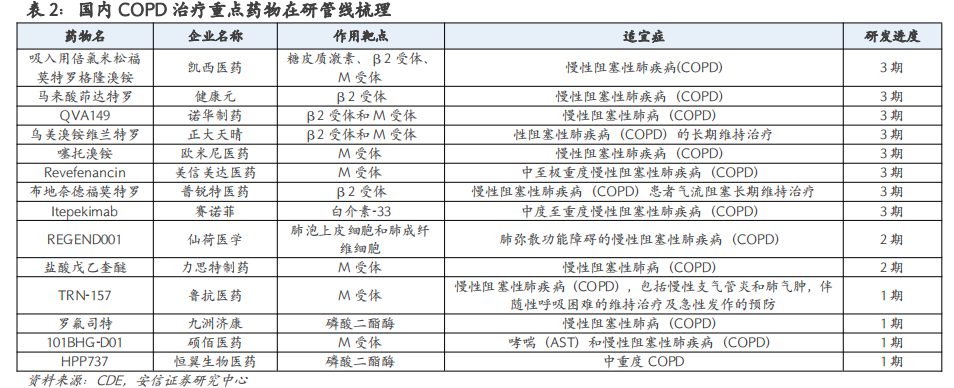
本周国内有49个新药获批IND,27个新药IND获受理,3个新药NDA获受理。
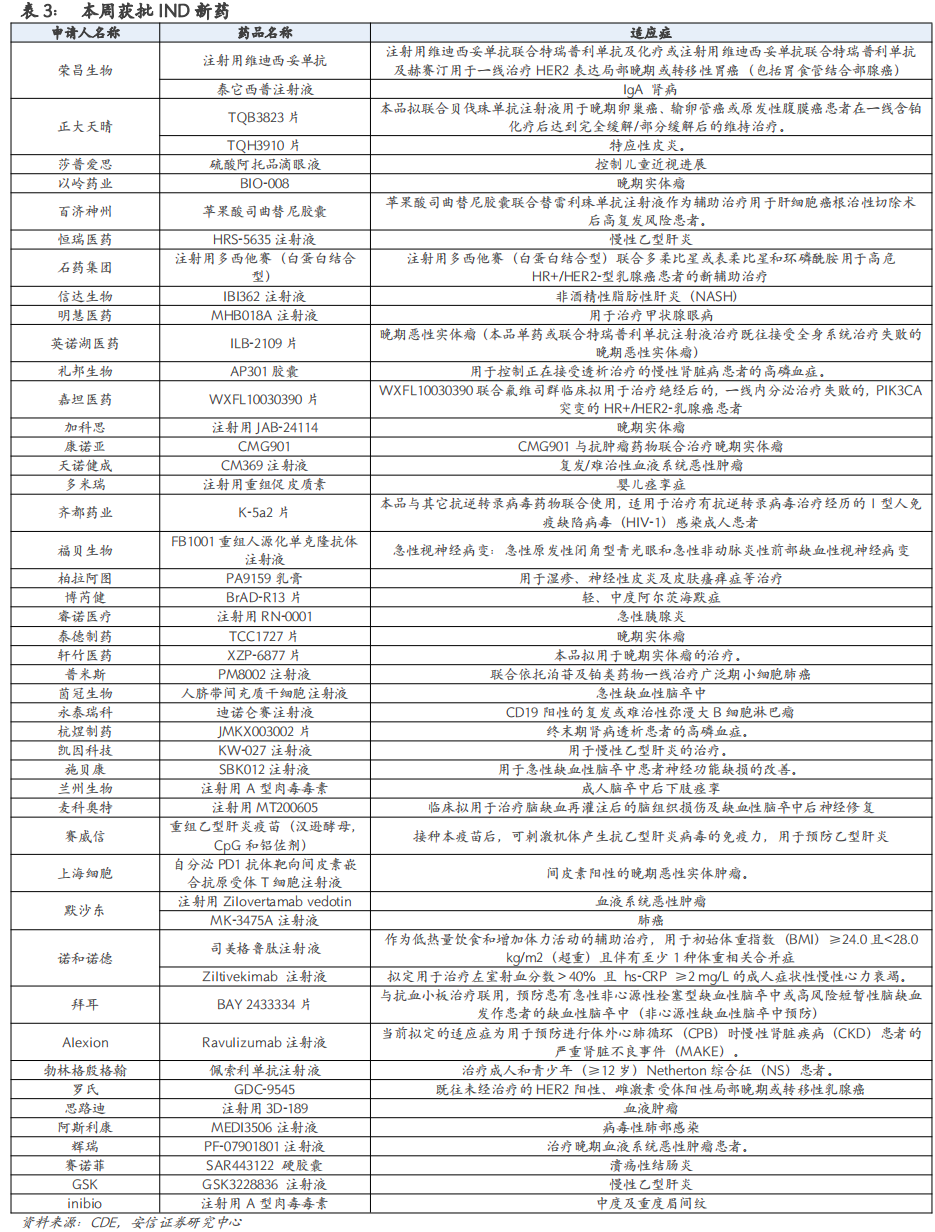
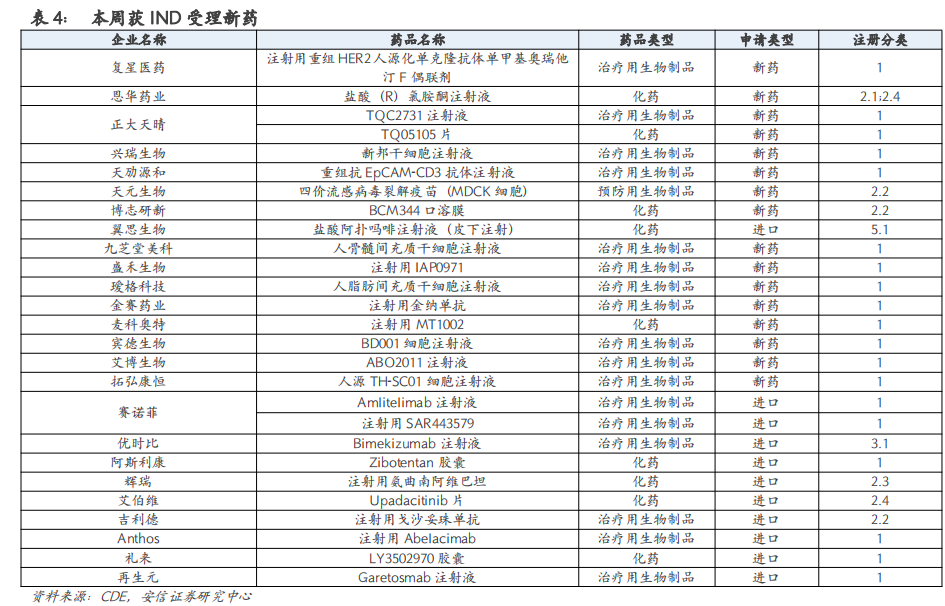
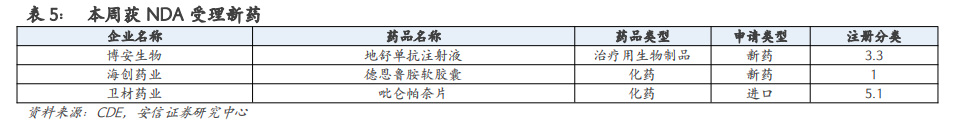
4. 本周国内新药行业重点关注
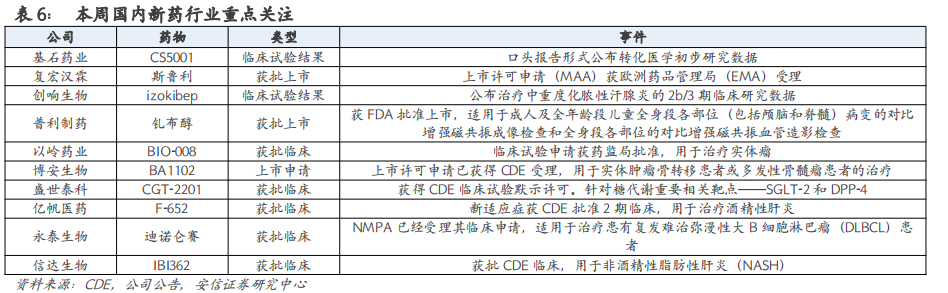
【基石药业】3月20日,展示CS5001转化医学研究重点探索其在实体肿瘤中的开发潜力,包括评估人体各种实体肿瘤样本中ROR1的表达情况。结果表明,ROR1在多种实体瘤组织中有表达,且CS5001对多种表达ROR1的血液瘤及实体瘤细胞展现出了较强的细胞毒性。
【复宏汉霖】3月24日,公司研发的抗PD-1单抗斯鲁利单抗(H药,中国商品名:汉斯状)联合化疗一线治疗广泛期小细胞肺癌的上市许可申请(MAA)获欧洲药品管理局(EMA)受理。2022年12月,该产品治疗小细胞肺癌已获得欧盟委员会(EC)授予的孤儿药资格。
【创响生物】3月20日,宣布与Affibody及ACELYRIN共同开发的IL-17A融合蛋白拮抗剂izokibep在治疗中重度化脓性汗腺炎的临床2b/3期研究数据在美国皮肤病学会(AAD)年会发表。已有数据显示,izokibep治疗12周后化脓性汗腺炎患者临床反应(HiSCR)显著增高,其中脓肿和炎性结节总数量100%减少(HiSCR100)的受试者高达33%。
【普利制药】近日,公告称其收到FDA签发的钆布醇注射液(规格:7.5mL:4.5354g,15mL:9.0708g )上市许可,适用于成人及全年龄段儿童全身段各部位(包括颅脑和脊髓)病变的对比增强磁共振成像检查和全身段各部位的对比增强磁共振血管造影检查。
【以岭药业】3月20日,发布公告其CLDN18.2单抗BIO-008临床试验申请获药监局批准,用于治疗实体瘤。这是该公司首个进入临床阶段的生物药。
【博安生物】3月21日,宣布其自主开发的肿瘤领域生物类似药——BA1102(地舒单抗注射液)的上市许可申请已获得CDE受理。BA1102是安加维的生物类似药,活性成分为RANK配体的免疫球蛋白G2全人源单抗,即地舒单抗。
【盛世泰科】3月21日,宣布CGT-2201获得中国国家药监局药品审评中心(CDE)临床试验默示许可。针对糖代谢重要相关靶点——SGLT-2和DPP-4,可以更好的用于糖尿病及其衍生疾病的治疗,包括糖尿病肾病和非酒精脂肪肝等。
【亿帆医药】3月20日,公告宣布其在研产品F-652(普罗纳亭,promenakin)新适应症获CDE批准2期临床,用于治疗酒精性肝炎。F-652是一种重组人白细胞介素22-Fc (IgG2)融合蛋白,Fc片段大大延长了白介素22的半衰期,从而显著提升药物的疗效。
【永泰生物】3月21日,宣布已获得中国国家药品监督管理局(NMPA)有关迪诺仑赛注射液的临床批准。迪诺仑赛注射液为靶向CD19抗原且拮抗TGF-β下游信号通路,拟开发用于治疗患有复发难治弥漫性大B细胞淋巴瘤(DLBCL)患者的注射液。
【信达生物】3月22日,IBI362新适应症获批临床,用于非酒精性脂肪性肝炎(NASH)。IBI362是GLP-1类双靶降糖药,靶点为 GLP-1R/GCGR。该药是与礼来共同开发的产物。当前,IBI362已经在2型糖尿病和肥胖症领域双线布局,均推进到3期临床。
5. 本周海外新药行业重点关注
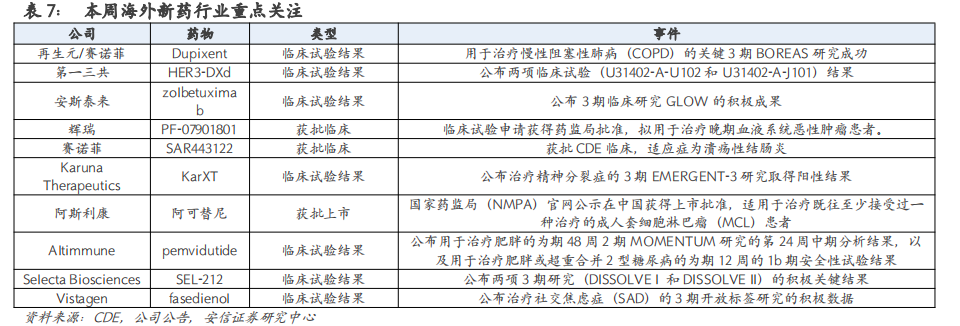
【再生元/赛诺菲】3月23日,宣布Dupixent(度普利尤单抗)用于治疗慢性阻塞性肺病(COPD)的关键3期BOREAS研究成功。数据显示,BOREAS研究达到了主要终点,即52周内中重度COPD的急性发作减少了30% (p=0.0005)。
【第一三共】3月20日,公布了patritumab deruxtecan (HER3-DXd)的两项临床试验(U31402-A-U102和U31402-A-J101)结果,在HER2(0)患者中,patritumab deruxtecan的疗效更为优异。
【安斯泰来】3月22日,公布zolbetuximab的3期临床研究GLOW的积极成果。相比于安慰剂联合CAPOX组,zolbetuximab与CAPOX联合用药将疾病进展或死亡风险降低了31.3%,达到GLOW研究的主要终点。

■行业评级体系
收益评级:
领先大市—未来6个月的投资收益率领先沪深300指数10%以上;
同步大市—未来6个月的投资收益率与沪深300指数的变动幅度相差-10%至10%;
落后大市—未来6个月的投资收益率落后沪深300指数10%以上;
风险评级:
A — 正常风险,未来6个月投资收益率的波动小于等于沪深300指数波动;
B — 较高风险,未来6个月投资收益率的波动大于沪深300指数波动;
■分析师声明
马帅声明,本人具有中国证券业协会授予的证券投资咨询执业资格,勤勉尽责、诚实守信。本人对本报告的内容和观点负责,保证信息来源合法合规、研究方法专业审慎、研究观点独立公正、分析结论具有合理依据,特此声明。
■本公司具备证券投资咨询业务资格的说明
安信证券股份有限公司(以下简称“本公司”)经中国证券监督管理委员会核准,取得证券投资咨询业务许可。本公司及其投资咨询人员可以为证券投资人或客户提供证券投资分析、预测或者建议等直接或间接的有偿咨询服务。发布证券研究报告,是证券投资咨询业务的一种基本形式,本公司可以对证券及证券相关产品的价值、市场走势或者相关影响因素进行分析,形成证券估值、投资评级等投资分析意见,制作证券研究报告,并向本公司的客户发布。
■免责声明
本报告仅供安信证券股份有限公司(以下简称“本公司”)的客户使用。本公司不会因为任何机构或个人接收到本报告而视其为本公司的当然客户。
本报告基于已公开的资料或信息撰写,但本公司不保证该等信息及资料的完整性、准确性。本报告所载的信息、资料、建议及推测仅反映本公司于本报告发布当日的判断,本报告中的证券或投资标的价格、价值及投资带来的收入可能会波动。在不同时期,本公司可能撰写并发布与本报告所载资料、建议及推测不一致的报告。本公司不保证本报告所含信息及资料保持在最新状态,本公司将随时补充、更新和修订有关信息及资料,但不保证及时公开发布。同时,本公司有权对本报告所含信息在不发出通知的情形下做出修改,投资者应当自行关注相应的更新或修改。任何有关本报告的摘要或节选都不代表本报告正式完整的观点,一切须以本公司向客户发布的本报告完整版本为准,如有需要,客户可以向本公司投资顾问进一步咨询。
在法律许可的情况下,本公司及所属关联机构可能会持有报告中提到的公司所发行的证券或期权并进行证券或期权交易,也可能为这些公司提供或者争取提供投资银行、财务顾问或者金融产品等相关服务,提请客户充分注意。客户不应将本报告为作出其投资决策的唯一参考因素,亦不应认为本报告可以取代客户自身的投资判断与决策。在任何情况下,本报告中的信息或所表述的意见均不构成对任何人的投资建议,无论是否已经明示或暗示,本报告不能作为道义的、责任的和法律的依据或者凭证。在任何情况下,本公司亦不对任何人因使用本报告中的任何内容所引致的任何损失负任何责任。
本报告版权仅为本公司所有,未经事先书面许可,任何机构和个人不得以任何形式翻版、复制、发表、转发或引用本报告的任何部分。如征得本公司同意进行引用、刊发的,需在允许的范围内使用,并注明出处为“安信证券股份有限公司研究中心”,且不得对本报告进行任何有悖原意的引用、删节和修改。
本报告的估值结果和分析结论是基于所预定的假设,并采用适当的估值方法和模型得出的,由于假设、估值方法和模型均存在一定的局限性,估值结果和分析结论也存在局限性,请谨慎使用。
安信证券股份有限公司对本声明条款具有唯一修改权和最终解释权。






















